La regulación del equilibrio ácido base es la regulación del pH de los líquidos corporales mediante la regulación del pH arterial. Las desviaciones de esta constante homeostática en cualquiera de los dos sentidos afecta el metabolismo celular y puede provocar graves trastornos que ponen en riesgo la vida del paciente. ¿Por qué? ¿Qué es el pH y qué mecanismos mantienen su constancia en condiciones normales? ¿Por qué un paciente diabético descompensado presenta trastornos de la conciencia, que pueden llegar hasta el coma? ¿Por qué la concentración de HCO-3 en plasma disminuye en la medida que se agrava su trastorno? ¿Por qué en ese estado el CO2 está disminuido en sangre arterial en tanto que la ventilación está incrementada? ¿Cómo se explica la presencia de abundantes sales de amonio en la orina de este paciente y cuál es su importancia? ¿Cuáles de las modificaciones antes mencionadas son expresión del trastorno del equilibrio ácido-base que presenta el paciente y cuáles son expresión de la puesta en marcha de los mecanismos reguladores?
Conceptos generales:
Nuestro metabolismo produce diariamente un exceso de ácidos por encima de la producción de bases, resulta comprensible entonces que la acumulación de ácidos inhibe las reacciones metabólicas, porque puede afectar la actividad de diversas enzimas y llega a causar depresión de la actividad metabólica del SNC, lo que explica el deterioro del estado de conciencia y el coma que puede desarrollarse en estos casos. Por el contrario, la disminución de la concentración de H+ provoca aumento de la actividad y excitabilidad neuronal y puede desencadenar estados convulsivos. La concentración de H+ en sangre arterial es de 40 nEqv/l es decir 0,00004 mEqv/l, estos valores tan pequeños resultan de difícil manejo, por lo que suele expresarse la concentración de H+ en forma de su – log, es decir se expresa como pH = – log [H+]. Esta forma de expresar la concentración de H+, implica que un incremento de dicha concentración se corresponde con una disminución del pH y a la inversa, una disminución de esta concentración equivale a un aumento pH. Dada la concentración de H+ en sangre arterial, el pH normal es de 7,4, con un estrecho rango de variabilidad normal de + 0,05.
![]()
El mantenimiento dentro de cifras normales de esta variable resulta más complejo que la eliminación de una cantidad similar por vía renal, como ocurre con otros iones analizados en el capítulo anterior, puesto que en este caso se involucran la respiración, la presencia de un conjunto de sustancias amortiguadoras en los líquidos corporales tanto intra como extracelulares y la propia función de la nefrona.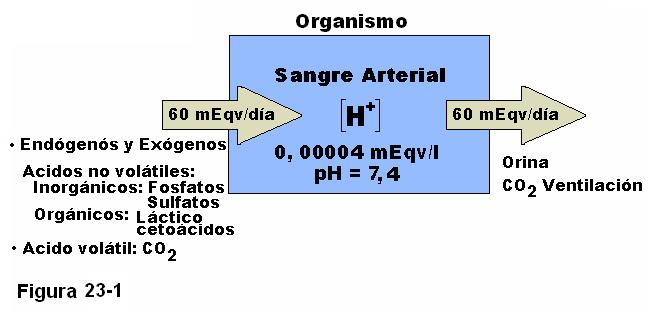
Para todos los análisis consideraremos como ácido a toda sustancia que cede H+ al medio y base toda sustancia que es capaz de captar H+.
Los mecanismos que regulan el equilibrio ácido base en el organismo son tres:
Regulación química, dada por la presencia en los líquidos corporales de sustancias amortiguadoras o buffer, que pueden captar o ceder protones y que por tanto impiden variaciones drásticas del pH de la solución en que están presentes.
Regulación respiratoria, dada por las modificaciones de la ventilación inducidas por los cambios del pH arterial y los efectos sobre el pH de las correspondientes modificaciones del CO2.
Regulación renal dada por la capacidad del riñón para formar una orina alcalina, rica en HCO3- en los estados de alcalosis o una orina ácida, sin eliminación de iones HCO3- e incluso formando nuevos durante una acidosis.
Estos mecanismos responden inmediatamente ante un cambio en la concentración de H+ del medio, sin embargo, de modo semejante a lo que ocurre con los mecanismos reguladores de la presión arterial difieren el tiempo en que se desarrolla la respuesta y en su capacidad para acercar el pH arterial, que es la variable regulada, a su valor normal. El análisis de cada uno de estos mecanismos y sus interacciones nos permitirá comprender las modificaciones observadas en el paciente diabético descompensado y su significación.
Regulación Química: Como hemos señalado en nuestros líquidos corporales existen sustancias que son buffer o amortiguadores acido base, ¿Qué es un amortiguador ácido-base? Es una mezcla de un ácido débil y su sal: Si la concentración de H+ del medio disminuye, el ácido cede protones al medio, impidiendo que el pH se eleve significativamente, lo inverso ocurre cuando la concentración de H+ se eleva, la sal se combina con el H+ impidiendo que el pH descienda marcadamente. Las proteínas tienen carácter anfótero, pues muchos de los residuos de aminoácidos, (no comprometidos en el enlace peptídico) se comportan como ácidos débiles y por tanto pueden captar o ceder protones al medio en dependencia del pH del mismo.
Si la concentración de H+ del medio disminuye, el ácido cede protones al medio, impidiendo que el pH se eleve significativamente, lo inverso ocurre cuando la concentración de H+ se eleva, la sal se combina con el H+ impidiendo que el pH descienda marcadamente. Las proteínas tienen carácter anfótero, pues muchos de los residuos de aminoácidos, (no comprometidos en el enlace peptídico) se comportan como ácidos débiles y por tanto pueden captar o ceder protones al medio en dependencia del pH del mismo.
Existe una ecuación, derivada matemáticamente de la constante de disociación del ácido débil, que permite calcular el pH de la solución en que se encuentra una determinada mezcla tampón, esa ecuación es la Ecuación de Henderson Hasselbach:
 Existen factores que determinan el poder amortiguador de una mezcla tampón, en primer lugar, su concentración en el sistema, si la concentración es baja, lógicamente el poder amortiguador lo es también y viceversa. El otro factor está dado por las concentraciones relativas de los dos componentes, puesto que si un determinado sistema amortiguador se encuentra predominantemente en una de las dos formas, por ejemplo la ácida, podrá amortiguar muy bien un aumento de pH, pero tendrá poco poder para amortiguar un descenso del pH. La condición ideal sería cuando ambos componentes se encuentren en las mismas proporciones. Si observamos la ecuación anterior, esa condición se cumple cuando el pH del medio es igual al pK del ácido débil. Por tanto mientras más cerca se encuentra el pH del medio del pK de un sistema amortiguador mayor poder amortiguador tendrá el sistema.
Existen factores que determinan el poder amortiguador de una mezcla tampón, en primer lugar, su concentración en el sistema, si la concentración es baja, lógicamente el poder amortiguador lo es también y viceversa. El otro factor está dado por las concentraciones relativas de los dos componentes, puesto que si un determinado sistema amortiguador se encuentra predominantemente en una de las dos formas, por ejemplo la ácida, podrá amortiguar muy bien un aumento de pH, pero tendrá poco poder para amortiguar un descenso del pH. La condición ideal sería cuando ambos componentes se encuentren en las mismas proporciones. Si observamos la ecuación anterior, esa condición se cumple cuando el pH del medio es igual al pK del ácido débil. Por tanto mientras más cerca se encuentra el pH del medio del pK de un sistema amortiguador mayor poder amortiguador tendrá el sistema.
¿Cuáles son los sistemas amortiguadores de nuestros líquidos corporales? Son tres, el de bicarbonato- ácido carbónico, el de fosfato básico y ácido y el de proteínas, cada uno difiere en concentración en los distintos compartimientos líquidos y en su pK.
El sistema bicarbonato - ácido carbónico, tiene un pK de 6,1, su concentración no es elevada en LEC y es menor aún en el LIC. El ácido carbónico es extremadamente inestable, por lo que se descompone rápidamente en dióxido de carbono y agua:

El sistema amortiguador de fosfato, es un sistema predominantemente intracelular y es también abundante en el líquido tubular renal, puesto que se filtra libremente, pero es pobremente reabsorbido:

El sistema amortiguador de proteínas tiene una elevada concentración en el líquido intracelular y en el plasma, está también presente en el líquido intersticial. Un caso particular por su abundancia de este sistema amortiguador es la hemoglobina, contenida en los glóbulos rojos, aunque en general la entrada de H+ a la célula se produce lentamente y demora varias horas. Las proteínas del LEC reaccionan de inmediato:

Si comparamos los tres sistemas amortiguadores, resulta evidente que el sistema de proteínas es el de mayor poder amortiguador, tanto por su concentración en los líquidos corporales, como por el hecho de que el pH de la sangre arterial está muy cerca de su pK. Sin embargo, este sistema no es el más importante en el organismo, esta condición le corresponde al sistema del bicarbonato, debido a que sus componentes resultan regulados uno por el sistema respiratorio y el otro por el riñón como veremos más adelante. Observe que todos estos sistemas tienen un elemento común que es el H+ este hecho se conoce como principio isohídrico, dicho principio puede expresarse en función de las constantes de disociación de los distintos sistemas o en la forma que proponemos a continuación y que resulta conveniente para el análisis de las desviaciones que ocurren en las distintas situaciones.
Al modificarse cualquiera de los componentes, se produce una desviación de la reacción en el sentido de disminución del cambio ocurrido, es decir en él se cumple la Ley de acción de masas o Principio de Lechatelier Brown. 
En un paciente diabético descompensado, el déficit de insulina impide la utilización de la glucosa como fuente de energía, por lo que se incrementa la betaoxidación de los ácidos grasos que tiene como consecuencia la acumulación de cetoácidos, lo que equivale a decir que aumentan las concentraciones de H+ o lo que es lo mismo, disminuye el pH, esta situación, en que se acumulan ácidos no volátiles se conoce como acidosis metabólica. El aumento del H+ hace que las reacciones se desvíen en el sentido de su combinación con las bases débiles, por lo que disminuyen las bases y aumentan las formas ácidas de los sistemas amortiguadores, esto nos explica por qué está disminuida la concentración de bicarbonato en este paciente, en la medida que se acumulan cetoácidos, se consume más bicarbonato y su concentración disminuye más en el plasma, aunque no llega a desaparecer, en primer lugar porque químicamente es imposible y en segundo porque el sistema renal participa en la regulación de este anión como veremos más adelante.

Contrariamente a lo que cabría esperar, el CO2 en este paciente no se encuentra aumentado, sino por el contrario, está disminuido. ¿Por qué?
Para dar respuesta a esta interrogante debemos analizar la regulación respiratoria del equilibrio ácido base
Regulación respiratoria:

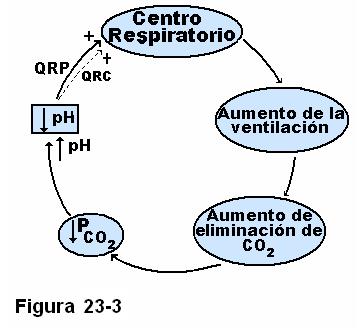
Como puede observarse en la Figura 23-2, la disminución del pH provoca un aumento de la ventilación, este efecto se produce mayormente a través de los cuerpos carotídeos y aórticos, puesto que la barrera hematoencefálica es poco permeable a los iones H+. La modificación de la actividad del centro respiratorio a través del quimiorreceptor central, sólo puede producirse cuando la concentración de H+ esté muy incrementada. Inversamente, un aumento del pH, provoca un inhibición del centro respiratorio y por tanto una disminución de la ventilación.
¿Por qué esta modificación de la ventilación constituye un mecanismo de control del equilibrio ácido-base? Si aplicamos la Ec. de H. Hasselbach al tampón bicarbonato, tendremos que:
 La constante 0,03 aparece por la sustitución del ácido carbónico, que no puede medirse debido a su inestabilidad. El CO2 representa el componente ácido del tampón bicarbonato, al incrementarse la ventilación se produce una aumento de la eliminación de dióxido de carbono y por tanto un incremento del pH, que se acerca a valores normales.
La constante 0,03 aparece por la sustitución del ácido carbónico, que no puede medirse debido a su inestabilidad. El CO2 representa el componente ácido del tampón bicarbonato, al incrementarse la ventilación se produce una aumento de la eliminación de dióxido de carbono y por tanto un incremento del pH, que se acerca a valores normales.
La Figura 23-3 ilustra este mecanismo. La regulación respiratoria se conoce como la regulación mecánica, por cuanto se produce mediante modificaciones de la ventilación, este mecanismo, si bien sólo acerca el pH a su valor normal (hasta alrededor de un 75%), actúa rápidamente y protege al organismo de cambios muy intensos del pH, dando tiempo al desarrollo de los mecanismos renales.
Resulta evidente entonces por qué un paciente en estado de acidosis metabólica, como el paciente diabético descompensado, presenta un incremento de la ventilación y un descenso de la presión parcial de CO2 en sangre arterial, esta última como expresión de la regulación respiratoria.
Una consecuencia importante de las relaciones antes analizadas entre el pH y la PCO2 es que en pacientes con trastornos ventilatorios, que cursan con retención de CO2 se produce un estado de acidosis respiratoria. En esta situación lógicamente el sistema respiratorio no participa en la regulación por cuanto es el generador del trastorno; los estados de hiperventilación se caracterizan por una disminución de la PCO2, por lo que se produce entonces una alcalosis respiratoria.
Regulación renal
¿Qué participación tiene el riñón en el control de la concentración de H+? ¿Por qué aparecen sales de amonio en la orina del paciente diabético descompensado? ¿Por qué se dice que el riñón regula el componente básico del tampón bicarbonato?
A través de la membrana glomerular se filtran tanto el H+ que está libre en plasma como el HCO3-, el primero como conocemos es muy poco, puesto que la concentración en plasma es de 0,00004 mEqv/l. El bicarbonato filtrado no puede ser reabsorbido directamente, puesto que las membranas de las células tubulares no son permeables, ni existe ningún mecanismo de transporte activo que garantice su recuperación. La pérdida del HCO3- filtrado llevaría a un estado de acidosis. La recuperación de esta sustancia se produce previa conversión en C02 en el líquido tubular y posterior reconversión en HCO3- que pasa al LEC y a los capilares peritubulares. Normalmente el 85% de la carga tubular de bicarbonato, se reabsorbe en el túbulo proximal, alrededor de un 10% en la rama ascendente gruesa del asa de Henle y el resto en el tubo colector, normalmente la orina prácticamente no contiene bicarbonato. En estados de acidosis el líquido tubular prácticamente no contienen bicarbonato cuando abandona el túbulo proximal.
La Figura 23-4 ilustra el mecanismo: La presencia de la enzima anhidrasa carbónica en el citoplasma y en el borde en cepillo de las células tubulares permite la rápida reacción del CO2 con el agua para formar ácido carbónico, que rápidamente se descompone en iones bicarbonato que difunden al LEC y a la sangre e hidrogeniones que son secretados activamente hacia la luz tubular, por un contratransporte con el Na+.
En la luz tubular el H+ secretado reacciona con el HCO3- filtrado, de modo que se forma ácido carbónico, que se descompone en CO2 y agua. El CO2 penetra en la célula tubular y sigue el proceso antes mencionado.

Observe que:
- La reabsorción de bicarbonato depende de su titulación con el H+. Por cada Na+ reabsorbido se secreta un H+ y se reabsorbe un HCO3-
- La recuperación del bicarbonato filtrado no introduce modificaciones del equilibrio ácido-base.
- La fuente a partir de la cual se forma el H+ es el CO2 de los líquidos corporales.
- Es importante tener siempre en cuenta la correspondencia entre Carga tubular (CT) de HCO3- y Cantidad Secretada (CS) de H+.
- Si la CT HCO3- > CS H+ se produce titulación incompleta a favor del HCO3- y éste se perderá por la orina. Esta es la regulación que ocurre en estados de alcalosis.
- Si la CT HCO3- < CS H+ la titulación es a favor del H+ y todo el bicarbonato será reabsorbido, quedando un exceso de H+ en la luz tubular. Esto es lo que ocurre en los estados de acidosis, y explica la ausencia total de bicarbonato en la orina del paciente diabético en acidosis.
¿Qué ocurre con el H+ secretado en exceso por encima del HCO3-? ¿Por qué aparecen sales de amonio en la orina?
La Figura 23-5 ilustra la respuesta a esas preguntas:
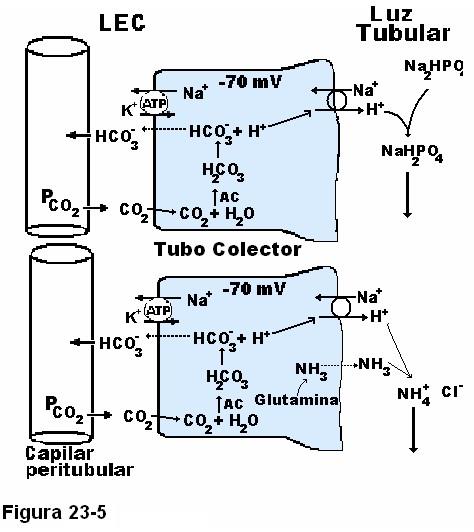
El H+ secretado en exceso por encima del bicarbonato filtrado reacciona con los amortiguadores de la luz tubular, esos amortiguadores son dos, el tampón fosfato que tiene mayor poder amortiguador en los líquidos tubulares porque se concentra en el líquido tubular y porque el pH del líquido tubular es ácido y se acerca más al pK de este sistema (6,8) y el sistema amoníaco-amonio, que actúa en las porciones finales de la nefrona: el NH3 se forma a partir de la glutamina y es secretado pasivamente a la luz tubular donde reacciona con el H+ en exceso. Estos sistemas amortiguadores impiden que el pH en la luz tubular descienda marcadamente, son muy importantes puesto que el pH 4,5 es el gradiente máximo contra el cual puede bombear el transporte activo Na+-H+, por tanto 4,5 es el límite inferior del pH en la orina. Todos los mecanismos que amortiguan H+ en la luz tubular permiten que se mantenga su secreción y eliminación por la orina.
Observe que en ambos casos:
Una vez que se ha rebabsorbido el HCO3- filtrado, cada H+ secretado representa un nuevo ión HCO3- que pasa a los líquidos corporales.
El H+ secretado proviene en todos los casos del CO2 de los líquidos corporales, por lo que las modificaciones de la PCO2 modificarán la CS H+
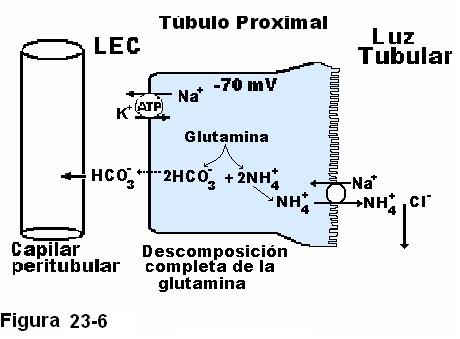
La presencia de sales de amonio en la orina se explica por el mecanismo antes expuesto y además por un mecanismo adicional que se produce en las células del túbulo proximal en las que la glutamina a través de pasos sucesivos, se descompone en dos aniones de HCO3- y dos iones amonio, que no puede difundir pasivamente, sino que es secretado en contratransporte con el Na+.
La Figura 23-6 ilustra dicho mecanismo. Observe que estos iones amonio no ejercen la función de tampón en a luz tubular, pero este proceso de descomposición completa de la glutamina aporta dos nuevos iones bicarbonato a los líquidos corporales. Las enzimas que catalizan la descomposición de la glutamina son activadas por el descenso del pH en los líquidos corporales. Este mecanismo responde de aproximadamente la mitad de los ácidos excretados en la orina y del nuevo bicarbonato formado en condiciones de acidosis. Es el mecanismo fundamental en los estados sostenidos de acidosis.
Un mecanismo adicional se produce en las células intercalares de la porción distal de la nefrona, que es la secreción por transporte activo primario de H+ (bomba de H+), esta secreción contribuye a la acidificación de la orina y como en el resto de los segmentos tubulares, el H+ secretado proviene del CO2 que se convierte en nuevas moléculas de bicarbonato que pasa a los líquidos corporales en condiciones de acidosis. El H+ secretado reacciona igualmente con los amortiguadores de la luz tubular. Figura 23-7

Resumiendo los aspectos relacionados con la regulación renal:
En condiciones de acidosis:
- Todo el bicarbonato es reabsorbido.
- Se secreta un exceso de H+ que reacciona con los amortiguadores de la luz tubular: fosfato y amoniaco.
- Cada H+ secretado en exceso representa un nuevo HCO3- que pasa a los líquidos corporales.
- Una fuente adicional de sales de amonio es la descomposición completa de la glutamina, que no aporta amortiguadores a la luz tubular, pero sí forma nuevo bicarbonato que va a los líquidos corporales.
- La fuente a partir de la que se forma el H+ secretado es siempre el CO2 por lo que la CSH+ se modifica de acuerdo a los niveles de PCO2 en los líquidos corporales.
- En todos los estados de acidosis la orina es ácida, esto no se cumple solamente cuando el origen del trastorno está en la función de los túbulos renales. Un ejemplo es la inhibición farmacológica de la anhidrasa carbónica, que deprime la secreción de H+ con la consecuente pérdida del HCO3- por la orina, lo que causa una acidosis metabólica, pero las orinas son alcalinas.
En condiciones de alcalosis tanto respiratoria como metabólica:
- La cantidad secretada de H+ será menor que la CT HCO3- , por lo que la orina será alcalina por la presencia de bicarbonato.
- Esta pérdida de bicarbonato por la orina contribuye a la regulación del estado de alcalosis.
- No se descompone la glutamina, por lo que no hay presencia de sales de amonio en la orina.
- Se elimina fosfato alcalino por la orina.
El mecanismo renal, como en otros casos de respuestas reguladoras de este sistema, actúa lentamente, pero es capaz de compensar la desviación del equilibrio ácido base y puede hacer que el pH se encuentre dentro de cifras normales.
Si retomamos nuestro paciente diabético descompensado, es evidente que está en un estado de acidosis metabólica:
- El exceso de ácidos no volátiles reacciona con el bicarbonato, como parte de la regulación química por lo que se consume, eso explica que el HCO3- en plasma esté disminuido, al igual que las formas básicas del resto de los sistemas amortiguadores.
- La disminución del pH mantiene excitado el centro respiratorio, por lo que está incrementada la ventilación y disminuida la PCO2
- A nivel renal ocurrirán las modificaciones correspondientes con un estado de acidosis (antes señaladas), la CT HCO3- < CSH+ pero en este caso ambas estarán disminuidas respecto al sujeto normal, la primera por su consumo y la segunda por el descenso de la presión parcial de CO2.
- La gasometría de este paciente mostrará: pH – disminuido; PCO2 - disminuida; HCO3- en plasma - disminuido.
En la práctica médica, una forma de evaluar la magnitud del estado de acidosis metabólica es la determinación de la brecha aniónica (anión gap). ¿Qué es la brecha aniónica? No existe tal brecha en realidad, sino que es un recurso para el diagnóstico: en la práctica médica cotidiana se determinan algunos compuestos iónicos y otros no, pero siempre se cumple que en los líquidos corporales existe electroneutralidad, por tanto la suma de los cationes es igual a la suma de los aniones; en el líquido extracelular los iones de Na+ serán la misma cantidad que los aniones presentes, de los cuales sólo suelen determinarse Cl- y HCO3-. Normalmente la suma de estos dos es menor que la concentración de Na+, esa diferencia es el anión gap, que normalmente es de unos 12 mEqv/l y corresponde a otros ácidos no volátiles. En estados de acidosis metabólica como hemos analizado el bicarbonato disminuye y se incrementan otros ácidos no volátiles (que no suelen medirse) por lo que en esta situación la brecha aniónica está incrementada y lo estará más en la medida que la acidosis sea más severa. Esto es muy importante puesto que la medición del pH no expresa completamente situación metabólica del paciente, ya que los mecanismos reguladores están constantemente modificando esta variable. La Figura 23-8 representa la brecha aniónica en condiciones normales.

¿Qué otras situaciones pueden dar lugar a estados de acidosis metabólica?
Puede producirse acidosis metabólica por pérdida de HCO3-, como ocurre en los cuadros diarreicos o por vómitos de contenido intestinal.
El metabolismo anaeróbico da lugar a producción de ácido láctico y por tanto a acidosis metabólica.
¿Cuál es la diferencia con una acidosis respiratoria?
En la acidosis respiratoria el problema primario es una hipoventilación que puede tener diversos orígenes y una acumulación de CO2 por lo tanto, la regulación química da lugar a un incremento del HCO3- y del H+ que es captado por los otros sistemas amortiguadores:

A nivel renal ocurren los procesos correspondientes a una acidosis pero en este caso aunque también se cumple que CT HCO3- < CSH+, ambas están aumentadas respecto al sujeto normal. El riñón formará intensamente nuevo HCO3- que contribuye a la compensación de la elevada presión de CO2
Los estados de alcalosis respiratoria se deben a estados de hiperventilación que determinan un descenso de PCO2, como ocurre en la altura, estados de ansiedad, etc. En esta situación, la regulación química determina un descenso del HCO3-, a pesar de lo cual el riñón formará una orina alcalina puesto que CT HCO3- > CSH+, pero ambas estarán disminuidas respecto al sujeto normal, una producto de la compensación química y la otra debido a la disminución del CO2 que caracteriza esta situación.
Los estados de alcalosis metabólica son menos frecuentes en la práctica médica, pueden ser consecuencia de ingestión de bases (bicarbonato, por ejemplo), vómitos de contenido gástrico, etc. En estas situaciones el HCO3- en plasma está elevado como consecuencia del déficit de H+; el aumento del pH deprime el centro respiratorio, por lo que la PCO2 estará elevada y a nivel renal se formará una orina alcalina puesto que CT HCO3- > CSH+ aunque ambas variables estarán aumentadas en comparación con el sujeto normal.
Finalmente es necesario tener en cuenta que en la práctica médica se observan con frecuencia pacientes con trastornos de mayor complejidad, en los que se mezclan desviaciones de origen metabólico y respiratorio, lo que hace mucho más complejo el manejo del paciente. Su análisis escapa de los objetivos del presente capítulo.
Resumiendo los aspectos abordados podemos destacar que el pH arterial se mantiene normalmente dentro de un muy estrecho margen de variaciones. Diversas situaciones pueden provocar trastornos del equilibrio ácido-base que pueden poner en riesgo la vida del paciente.
En los trastornos de origen metabólico la causa primaria es un aumento o disminución de la concentración de H+ y en su compensación participan todos los mecanismos reguladores: la regulación química cumpliendo la Ley de Acción de masas, la regulación respiratoria modificando la ventilación y la PCO2 como consecuencia de la modificación del pH arterial y la regulación renal formando una orina que corresponde con la desviación ácido- base que sufre el paciente siempre que la causa no sea de origen renal.
En los trastornos de origen respiratorio la causa primaria es una modificación de la PCO2 que es necesario tener en cuenta al analizar la compensación química, el sistema renal igualmente forma una orina que corresponde con la desviación que sufre el paciente y el sistema respiratorio no participa a menos que desaparezca la causa que originó el trastorno de la ventilación.
